Проект по химии "Вода как реактив и среда для химических процессов". Вода как реагент и как среда для химического процесса
Проект по химии "Вода как реактив и среда для химических процессов"
Министерство образования Нижегородской области
Государственное бюджетное профессиональное
образовательное учреждение
«Борский Губернский колледж»
18.02.05 Производство тугоплавких неметаллических и силикатных материалов и изделий
Проект по биологии
на тему:
«Вода как реактив и среда
для химических процессов»
Выполнил:
студент группы ТС-11
Арнаутов Е.И.
Проверила:
преподаватель биологии
Устинова А.Н.
Городской округ город Бор
2016 г.
Оглавление
Введение…………………………………………………………………………...3
1. Строение молекулы воды………………………………………………………3
2. Физические свойства воды…………………………………………………......6
3. Химические свойства воды…………………………………………………….6
4. Виды воды……………………………………………………………………….7
5. Почему не кончается вода на Земле?.................................................................8
6. Вода в природе………………………………………………………………….9
7. Аномалии воды…………………………………………………………………9
8. Применение воды……………………………………………………………...11
Заключение……………………………………………………………………….12
Список литературы………………………………………………………………13
Введение
Вода (оксид водорода) - бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного - кислорода, которые соединены между собой ковалентной связью.
Вода, не является питательным веществом, но она жизненно необходима, как стабилизатор температуры тела, переносчик питательных веществ и пищеварительных отходов, реагент и реакционная среда в ряде химических превращений. Кроме того, вода формирует органолептические показатели продукта.
Общий запас воды на Земле составляет 1359000 м3. Около 70% поверхности планеты покрыто морями и океанами, но эта вода - соленая. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступно людям, так как это ледники северного Ледовитого океана, Гренландии, Антарктиды.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
Вода - самое удивительное соединение на Земле.
1. Строение молекулы воды
Вода (оксид водорода) Н2О - простейшее устойчивое соединение. Молекула воды (h3O) состоит из двух атомов водорода (h2) и одного атома кислорода (O16).
Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород - 88,81%.
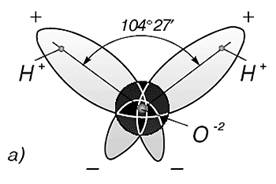
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине.
Модель молекулы воды, предложенная Нильсом Бором:
Свойства воды в основном зависят от величины водородных связей.
Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода.
По этой причине, а также из-за того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы.
Благодаря чему, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
infourok.ru
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Вятский Государственный Гуманитарный Университет
Химический факультет
Реферат по дисциплине :
Химия
«Вода как реагент и как среда для химического процесса (аномальные свойства воды)»
Выполнила студентка I курса
Химического факультета
Учебной группы ЭПБ – 11
Мисюкевич Дарья Анатольевна
Преподаватель:
к.п.н Даровских Л.В.
Киров 2013
План:
- Введение
- Структура молекул воды
- Химические свойства воды
1.Введение
Вода́ (оксид водорода) — бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (нагидрофильных поверхностях).
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % на ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Бо́льшая часть земной воды — солёная, и она непригодна для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах.
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли,газы)
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ на планете Земля.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества. Вода – самое удивительное соединение на Земле.
2.Внутренняя структура молекул воды
Вода (оксид водорода) h3O − простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19 % по массе, а на кислород – 88,81 %.
Восемь электронов внешнего электронного слоя атома кислорода образуют четыре электронные пары, из которых 2 создают ковалентные связи О−Н, а две другие представляют собой неподеленные электронные пары.
С современных позиций строения атома электронное облако молекулы воды имеет вид усеченного четырехлопастного винта, который может быть размещен в неправильном кубе (неправильный тетраэдр). Атом кислорода оказывается при этом в центре, а два атома водорода − в противоположных
углах одной из граней куба. Угол между ними составляет 104°31'. Два из восьми электронов атома кислорода расположены около ядра, два других связаны с атомами водорода, а две неподеленные пары электронов образуют ветви, расположенные в противоположном направлении по отношению к электронным облакам водородов. Таким образом, электронное облако молекулы воды имеет вид
четырех лепестков, направленных к вершинам неправильного тетраэдра. В двух вершинах одной грани находятся электронные пары, осуществляющие связь О—Н, а в двух вершинах противоположной грани находятся неподеленные электронные пары атома кислорода .Электронное облако в молекуле воды смещается к атому кислорода, так как он имеет большую электроотрицательность. Вследствие этого вблизи ядер атомов водорода создается избыток положительного заряда. Поэтому молекула воды полярна. Полярные молекулы характеризуются электрическим моментом диполя, который влияет на свойства веществ, состоящих из таких молекул. Электрический момент диполя представляет собой произведение одного из зарядов на расстояние между центрами положительного и отрицательного заряда. Расстояние между ними составляет 0,9568 Å. Для воды электрический момент диполя p = el равен 6*10-28 Кл-м или 1,8 дебая (1,8 * 10-18 ед. СГСЭ).Благодаря большому значению электрического момента диполя между молекулами воды проявляется сильное взаимодействие за счет образования водородных связей между атомом кислорода одной молекулы воды и атомом водорода другой. Водородная связь возникает в результате внедрения очень малого по мразмерам положительно поляризованного атома водорода одной молекулы в электронную оболочку отрицательно поляризованного атома кислорода другой молекулы воды. Длина водородной связи О ... Н изменяется в пределах от 1,76 А. Энергия ее составляет 17—33 кДж/моль.
Возникновение водородной связи объясняется свойством атома водорода взаимодействовать с сильно электроотрицательным элементом, например с кислородом другой молекул воды. Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной, оболочки. Поэтому он не испытывает отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие. Следует отметить, что согласно принятым представлениям водородную связь нельзя рассматривать как чисто электростатическую. Согласно методу молекулярных орбиталей водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
Каждая молекула воды может образовать четыре водородных связи: две возникают при взаимодействии неподеленных электронных пар атома кислорода с атомами водорода соседних молекул воды и две дают атомы водорода, взаимодействующие с атомами Существованием водородных связей объясняется аномально высокая температура плавления воды по сравнению с водородными соединениями аналогов кислорода (h3S, h3Se, h3Te). Водородные связи и донорно-акцепторные взаимодействия способствуют возникновению высокой упорядоченности внутренней структуры в жидкой воде. Водородные связи обусловливают высокое внутреннее давление, которое и способствует появлению у воды некоторых особых свойств
3.Химические свойства воды
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катионH+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
- Воду можно получить в ходе реакций:
- В ходе реакций нейтрализации:
- Восстановлением оксида меди водородом :
- Вода реагирует при комнатной температуре:
- С активными металлами (натрий, калий, кальций, барий и др.)
- Со фтором и межгалоидными соединениями
(при низких температурах)
- С солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз:
- С ангидридами и галогенангидридами карбоновых и неорганических кислот
- С активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- С карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- Со многими солями, образуя гидраты
- С боранами, силанами
- С кетенами, недоокисью углерода
- С фторидами благородных газов
Вода реагирует при нагревании:
- С железом, магнием:
- с углем, метаном:
- С некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
- Разложение в образование воды в биосфере
Для одних и тех же атомов водорода и кислорода вода не является постоянной формой нахождения. Растения в процессе фотосинтеза разлагают воду . выделяя кислород в атмосферу. Разложение воды происходит в условиях биосферы и при процессах химического выветривания минералов. К числу наиболее распространенных среди них относятся силикаты . Их изменения в условиях биосферы можно выразить реакцией:
2Ca [Al2Si2O8] + 6 h3O = Al4 [Si4 O15] (OH) 4 + 2Ca2+ + 4OH-
Выветривание других силикатов ,а также сульфидов , карбонатов, сульфатов тоже идет с разложением воды.
Существенное влияние на растворимость минералов оказывает широко распространенная в биосфере углекислота. Однако в её присутствии продолжается разложение воды:
Аномалии воды
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Плотность
- Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность.
- Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода здесь представляет исключение.
- При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
- Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Поверхностное натяжение
- Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
- Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
- Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
yaneuch.ru
7. Аномалии воды. Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Похожие главы из других работ:
Вода известная и неизвестная. Память воды
4. Свойства воды
...
Вода известная и неизвестная. Память воды
5. Память воды
...
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
4. Виды воды
Бромная вода -- насыщенный раствор Br2 в воде (3,5% по массе Br2). Бромовая вода -- окислитель, бромирующий агент в аналитической химии. Аммиачная вода -- образуется при контакте сырого коксового газа с водой...
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
8. Применение воды
Роль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды. 1. В сельском хозяйстве для полива растений и питания животных 2. В химической промышленности для получения кислот, оснований, органических веществ. 3...
Вода, дарующая жизнь
1.2 Химическая природа воды и ее память (структура, свойства, состав воды)
Вода представляет собой важнейшее химическое соединение, определяющее возможность существования жизни на Земле. Ежедневное потребление человеком питьевой воды составляет в среднем около 2 л...
Водород - топливо будущего
ОТВОД ВОДЫ
Следующей проблемой, где невесомость вновь заявила о себе, стала проблема отвода образующейся в топливном элементе воды. Если ее не удалять, она покроет электрод пленкой и затруднит к нему доступ для газа...
Информационно-структурная память воды
1.1 Структура воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра...
Определение жесткости воды комплексонометрическим методом
1.3 Жесткость воды
Ввиду широкой распространенности кальция, соли его почти всегда содержатся в природной воде. Из природных солей кальция только гипс несколько растворим в воде, однако, если вода содержит диоксид углерода...
Расчет и подбор выпарной установки
6.1.1. Расход охлаждающей воды Gв.
Gв определяют из теплового баланса конденсатора: Gв=W3(hбк-cвtк)/cв(tk-tн), где hбк - энтальпия паров в барометрическом конденсаторе; tн = 200С - начальная температура охлаждающей воды; Cв =4...
Расчет и проектирование двухкорпусной выпарной установки
4.1 Расход охлаждающей воды
Расход охлаждающей воды GВ определяют из теплового баланса конденсатора: , где IБК - энтальпия паров в барометрическом конденсаторе, Дж ?кг; tн - начальная температура охлаждающей воды, 0С...
Сорбционная очистка воды
1. Качество воды
В производстве устанавливается в зависимости от требований технологического процесса. Вода, используемая в производстве...
Сорбционная очистка воды
5.1 Очистка воды
Для предупреждения развития бактериальных биологических обрастаний в теплообменных аппаратах, а также в трубопроводах рекомендуется периодически 3-4 раза в сутки применять хлорирование воды, продолжительностью каждого периода 40-60 минут...
Сорбционная очистка воды
5.3 Умягчение воды
Одним из наиболее распространенных видов кондицирования воды является её умягчение. Первым промышленным способом устранения солей жесткости был содово-известковый...
Сульфат кальция, кристаллогидрат и безводная соль
1.4 Жёсткость воды
Содержание в воде CaSO4 наряду с MgCl2, MgSO4 придаёт воде постоянную жёсткость. Избавиться от жёсткости воды можно с помощью умягчения воды. Химическое умягчение воды основано на введении в воду реагентов, обогащающих её анионами CO3 2- и ОН-...
Удивительное вещество - вода
ИССЛЕДОВАНИЯ ВОДЫ
Гидроломгия -- наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.). Предметом изучения гидрологии являются все виды вод гидросферы в океанах...
him.bobrodobro.ru
Заключение. Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Вода - универсальный растворитель.
Вода является незаменимым веществом для всего живого на земле.
Вода - самое удивительное соединение на Земле.
Вода - одно из самых распространенных веществ на нашей планете.
Считают, что вода самое простое вещество на Земле. Она имеет огромное значение в эволюции как живой, так и неживой природы.
Покрывает 70% поверхности Земли и является средой обитания большого количества представителей флоры и фауны. Человеческое тело содержит около 65% воды.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое.
Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды.
Список литературы
1. Д.Э., Техника и производство. Москва, 1972 г.
2. Хомченко Г.П., Химия для поступающих в ВУЗы. Москва, 1995 г.
3. Прокофьев М.А., Энциклопедический словарь юного химика. Москва, 1982 г.
4. Глинка Н.Л., Общая химия. Ленинград, 1984 г.
5. Ахметов Н.С., Неорганическая химия. Москва, 1992 г.
6. Петрянов И.В., Самое необыкновенное вещество в мире. Москва, 1975г.
7. Алексинский В.Н. Занимательные опыты по химии: Пособие для учителей. - М.: Просвещение, 1980 г.
8. Чернова Н.М., Былова А.М., "Экология".
9. http://www.habit.ru
10. http://food-chem.ru
11. http://t-water.ru
12. http://refdb.ru
13. https://ru.wikipedia.org
him.bobrodobro.ru
8. Применение воды. Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Похожие главы из других работ:
Вода известная и неизвестная. Память воды
4. Свойства воды
...
Вода известная и неизвестная. Память воды
5. Память воды
...
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
4. Виды воды
Бромная вода -- насыщенный раствор Br2 в воде (3,5% по массе Br2). Бромовая вода -- окислитель, бромирующий агент в аналитической химии. Аммиачная вода -- образуется при контакте сырого коксового газа с водой...
Вода как реагент и как среда для химического процесса (аномальные свойства воды)
7. Аномалии воды
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей...
Вода, дарующая жизнь
1.2 Химическая природа воды и ее память (структура, свойства, состав воды)
Вода представляет собой важнейшее химическое соединение, определяющее возможность существования жизни на Земле. Ежедневное потребление человеком питьевой воды составляет в среднем около 2 л...
Водород - топливо будущего
ОТВОД ВОДЫ
Следующей проблемой, где невесомость вновь заявила о себе, стала проблема отвода образующейся в топливном элементе воды. Если ее не удалять, она покроет электрод пленкой и затруднит к нему доступ для газа...
Информационно-структурная память воды
1.1 Структура воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра...
Информационно-структурная память воды
2. Практическое применение информационно - структурной памяти воды
...
Обезжелезивание воды
4. Методы обезжелезивания воды
Выбор метода удаления железа из природных вод зависит от форм, количества железа и буферных свойств исходной воды...
Определение жесткости воды комплексонометрическим методом
1.3 Жесткость воды
Ввиду широкой распространенности кальция, соли его почти всегда содержатся в природной воде. Из природных солей кальция только гипс несколько растворим в воде, однако, если вода содержит диоксид углерода...
Сорбционная очистка воды
1. Качество воды
В производстве устанавливается в зависимости от требований технологического процесса. Вода, используемая в производстве...
Сорбционная очистка воды
5.1 Очистка воды
Для предупреждения развития бактериальных биологических обрастаний в теплообменных аппаратах, а также в трубопроводах рекомендуется периодически 3-4 раза в сутки применять хлорирование воды, продолжительностью каждого периода 40-60 минут...
Сорбционная очистка воды
5.3 Умягчение воды
Одним из наиболее распространенных видов кондицирования воды является её умягчение. Первым промышленным способом устранения солей жесткости был содово-известковый...
Сульфат кальция, кристаллогидрат и безводная соль
1.4 Жёсткость воды
Содержание в воде CaSO4 наряду с MgCl2, MgSO4 придаёт воде постоянную жёсткость. Избавиться от жёсткости воды можно с помощью умягчения воды. Химическое умягчение воды основано на введении в воду реагентов, обогащающих её анионами CO3 2- и ОН-...
Удивительное вещество - вода
ИССЛЕДОВАНИЯ ВОДЫ
Гидроломгия -- наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.). Предметом изучения гидрологии являются все виды вод гидросферы в океанах...
him.bobrodobro.ru
Вода как химический реагент - Справочник химика 21
Химические методы основаны на образовании нетоксичных продуктов в результате обработки сточных вод химическими реагентами и протекания различных реакций нейтрализации, конденсации, окисления, восстановления. Этот метод связан с большими расходными коэффициентами по реагентам и ведет к образованию новых соединений, которые хотя и не токсичны, но в свою очередь засоряют водоемы. В этой группе следует выделить хлорирование— обработку сточных вод хлором или его кислородными соединениями. Этот прием часто применяется для дезинфекции сточных вод, их дезодорации, уничтожения грибков и других вредных организмов, обезвреживания цианистых соединений и пр. [c.248] Грунт, содержащий растворенные в воде химические реагенты, обладает ионной электропроводностью. Это делает его коррозионноактивным электролитом по отношению к металлическим конструкциям. В большинстве случаев, за исключением сухих грунтов, подземная коррозия металлов протекает по электрохимическому механизму. [c.45]Наличием в воде поверхностно-активных веществ обусловлена также гидратация поверхностей газовых пузырьков в воде. В результате адсорбции на границе раздела фаз газ—вода химические реагенты ориентируются полярными группами в сторону воды и упорядочивают ее молекулы. Под воздействием адсорбировавшегося химического реагента весь пузырек окружается гидратной оболочкой. Причем гидратные оболочки отдельных полярных групп органических молекул препятствуют их предельному уплотнению в поверхностном слое и играют роль поверхностной пленки, занимая в них большие площади, чем молекулы поверхностно-активных веществ. [c.59]
Химическая очистка сточных вод. Химической очисткой называется обработка воды химическими реагентами для выделения из нее примесей в виде осадка или газа. [c.234]
Обеспечение чистоты поверхности теплообмена возможно двумя путями периодической химической очисткой оборудования, заключающейся в растворении отложений, либо стабилизационной обработкой воды химическими реагентами. И тот и другой способы успешно реализуются с помощью комплексонов. [c.456]
К физико-химическим методам предупреждения отложений относят магнитный способ, а также обработку оборотной воды химическими реагентами. [c.40]
Для ускорения выпадения взвеси применяется коагулирование, осуществляемое путем добавки в обрабатываемую воду химических реагентов коагулянтов), образующих хлопья, которые, оседая, увлекают з а собой взвесь. [c.32]
Эти недостатки побудили Академию коммунального хозяйства им. К. Д. Памфилова разработать способ обеззараживания (Воды бактерицидными лучами. Предложенный ею способ автоматичен, не требует введения в воду химических реагентов, не влияет на вкус и запах воды и действует ле только на вегетативные бактерии, но и на бактериальные споры. Действие бактерицидного облучения является почти мгновенным, и, следовательно, вода, прошедшая че- рез установку, может сразу же поступать непосредственно к потребителю. [c.204]
Нами установлено, что гидроокись алюминия, полученная электрохимическим методом, обладает значительно большей сорбционной способностью по отношению к ряду загрязнений воды (гумусовым веществом, железу, кремнию и др.), чем гидроокись алюминия, образовавшаяся в результате гидролиза его солей. Последнее можно объяснить особыми условиями формирования коагуляционных структур в электролизере, а также гораздо меньшим влиянием анионов сильных кислот, концентрация которых в этом случае значительно ниже, чем при введении в воду химических реагентов. [c.155]
Обеззараживание облучением не требует введения в воду химических реагентов, не изменяет физико-химических свойств примесей и не оказывает влияния на вкусовые качества воды. Однако применение этого метода сопряжено со значительными материальными затратами и отсутствием последействия, что ограничивает его применение, так как не исключается опасность повторного заражения воды. [c.357]
Обработка воды химическими реагентами в сочетании с физическими методами — отстаиванием, фильтрованием, сорбцией и др. — дает возможность получить воду любого заданного качества. [c.3]
Следует отметить, что процессы обработки воды химическими реагентами, с точки зрения их регулирования, принципиально не отличаются от процессов, встречающихся в энергетике и химии. Поэтому на водоочистных станциях могут найти применение все промышленные регуляторы от простейших позиционных [c.4]
Одной из важнейших характеристик воды и водных растворов является показатель активной концентрации водородных ионов pH. Он характеризует степень кислотности или щелочности данного раствора, определяет скорость и направление многих химических реакций, в том числе и реакций, происходящих при обработке воды химическими реагентами. [c.6]
Консервирование сточных вод весьма затруднительно, в особенности при наличии в пробе нерастворимых веществ, так как консервирующее вещество может оказать мещающее действие. Консервирование сточных вод химическими реагентами допустимо только в том случае, если консервирующий реагент не препятствует определению тех или иных компонентов сточной воды и если определение невозможно провести непосредственно после отбора пробы. [c.38]
Химической очисткой называется обработка воды химическими реагентами для выделения из нее примесей в виде осадка или газа. [c.233]
В промышленности используется защита стальных изделий и кабелей в агрессивной атмосфере — морской воде, химических реагентах или растворителях. [c.52]
Обычно стабилизация охлаждающей воды совмещает комплекс мероприятий, включающих как продувку, так и обработку воды химическими реагентами. К химическим методам обработки охлаждающей воды относятся подкисление, рекарбонизация, фосфатирование. [c.156]
Для удаления соединений фосфора в основном применяется обработка сточных вод химическими реагентами с целью перевода растворимых форм соединений фосфора в нерастворимые. При этом достаточно эффективными реагентами являются известь, соли алюминия и железа. Возможно также применение высокомолекулярных полиэлектролитов. Указанные реагенты используются самостоятельно или в сочетании друг с другом. [c.110]
Для удаления соединений фосфора в основном применяется обработка сточных вод химическими реагентами с целью перевода растворимых форм соединении фосфора в нерастворимые. При этом достаточно эффективными средствами являются известь, соли алюминия и железа. Возможно применение высокомолекуляр- [c.71]
Большое содержание прочно связанного хлора, высокие молекулярный вес и степень кристаллического полимера с плотной упаковкой обусловливают стойкость покрытий к действию воды, химических реагентов и растворителей даже при сравнительно высоких температурах (до 120—135 °С). [c.317]
Наибольшее применение в технике получили сополимеры винилиденхлорида с небольшим количеством (10—20%) хлористого винила. Они легче перерабатываются, чем гомополимеры, и обладают малой горючестью, повышенной теплостойкостью, а также устойчивостью к действию света, озона, воды, химических реагентов и большинства органических растворителей. Сополимеры растворяются только при нагревании в о-дихлорбензоле, диоксане, цикло- [c.90]
Эти методы очистки в ряде случаев имеют определенные преимущества перед обработкой сточных вод химическими реагентами, а именно позволяют извлечь из них многие ценные продукты значительно упростить технологическую схему и эксплуатацию производственных установок сравнительно легко автоматизировать их работу уменьшить производственные площади, необходимые для размещения очистных сооружений. Эти методы дают возможность обрабатывать сточные воды без их предварительного разбавления, не увеличивают солевой состав очищенных сточных вод и нередко позволяют избежать образования осадков или значительно уменьшить их количество. [c.94]
Очистка доменных газов. Вода после скрубберов содержит взвешенные частицы или дисперсную золу, количество которых зависит от степени очистки газов. Хотя еще несколько лет назад для очистки воды после скрубберов применяли безреагентное отстаивание в радиальных отстойниках со скребковыми механизмами или в горизонтальных отстойниках, в настоящее время для этой цели используют обработку воды химическими реагентами, а затем воду или сбрасывают, или подают на рециркуляцию, не нанося ущерба оборудованию скрубберов. [c.126]
Покрытия на основе полиэтилена являются стойкими при комнатной температуре к действию воды, химических реагентов (кислот и щелочей), вина, углекислого газа, растворителей и сохраняют эластичность при низких температурах. [c.61]
Лакокрасочные материалы на основе поливинилхлоридных смол быстро высыхают при комнатной температуре, образуя покрытия, обладающие рядом ценных свойств—негорючестью, стойкостью к действию воды, химических реагентов (кислот, щелочей, растворов солей, газов) и некоторых органических растворителей. [c.349]
Покрытия на основе хлоркаучуков обладают негорючестью, стойкостью к действию воды, химических реагентов, атмосферостойкостью и удовлетворительными электроизоляционными свойствами. Они быстро сохнут и получаются достаточно твердыми. [c.388]
Природа физико-химических взаимодействий в промывочных жидкостях определяется действующими межатомными и молекулярными силами. Эти силы, обусловленные расположением и движением в атомах и молекулах электрических зарядов и вследствие этого имеющие электрическую природу, определяют свойства и характер взаимодействия компонентов, которые содержатся в фазах промывочных жидкостей — минералов, воды, химических реагентов, газов и др. Несмотря на единую электрическую природу, эти силы различны, а потому отличаются и связи, возникающие при их взамодействии. В настоящее время различают пять основных форм связи ионную (гетеронолярную), ковалентную (неполярную или гомеополярную), водородную, металлическую и молекулярно-поляризационную, обусловленную силами Ван-дер-Ва-альса. [c.7]
Среди различных методов биологическая очистка производственных сточчгых вод в аэротенках, по-видимому, является наиболее эффективной для снижения содержания фосфора. Остаточное количество фосфора после обработки в аэротенках и вторичных отстойниках может быть удалено на скорых фильтрах с обработкой сточных вод химическими реагентами — солями алюминия и железа, полиэлектролитами. Расходы реагентов определяются опытиыгл путем. Наименьший расход реагентов наблюдается при введении их в биологически очищенные сточные воды перед скорыми фильтрами путем использования метода контактного коагулирования. [c.225]
Хотя до сих пор не удавалось термически отщепить воду от р-аминокислот с образованием р-лактамов, однако известно по меньшей мере два случая, где желаемый результат был получен при отщеплении воды химическими реагентами. Так, Штаудингеру при действии хлористоГЬ ацетила [43] удалось превратить в р-лактам р-бензиламино-р-фенил-а,а-диметилпропио-новую кислоту [c.81]
Почти во всех штатах теперь требуется проведение анализа обработанной воды на колиформные бактерии в этом случае число требуемых анализов зависит от численности обслуживаемого населения. Подсчет фекальных колиформ, хотя он обычно необязателен с точки зрения контролирующих органов, несложен и может дать дополнительную инь формацию относительно источников загрязнения. Иногда применительно к конкретной установке специально устанавливают предельные значения некоторых показателей, таких, как концентрация остаточного хлора, мутность, содержание растворенных твердых частиц, нитратов, а также цветность. Концентрацию остаточного хлора в распределительной системе измеряют для того, чтобы определить, является ли достаточным хлорирование. Другие лабораторные анализы связаны с контролем химической обработки, выявлением и устранением некоторых проблем, возникающих в сооружениях распределительной системы, и с жалобами потребителей на качество воды. Химические реагенты должны отвечать требованиям соответствующих технических условий, и их следует подвергать традиционным анализам, причем при отклонении от технических условий на поставщика необходимо накладывать штраф. Например, известь обычно покупают с содержанием СаО 88—90%, квасцы—с 17%-ным содержанием AI2O3, а активный уголь — по спецификациям относительно содержания фенола. Если в контракте на поставку химических веществ предусмотрено наложение штрафов на поставщика на основании результатов лабораторных анализов, то это может оградить водоочистную установку от поступления в нее недоброкачественных материалов. [c.233]
В целях повышения эффективности работы отстойников, особенно при содержании в сточной воде взвешенных веществ более 300 мг/л, необходимо принимать дополнительные меры а) добавлять к сточным водам химические реагенты — коагулянты, способствующие увеличению гидравлической крупности частиц примесей б) добавлять хорошо оседающие взвешенные вещества, в частности, активный ил, выполняющий роль сорбента и биокоагулянта в) предварительно аэрировать сточные воды, что способствует флокуляции (хлопьеобразованню и укрупнению) находящихся в сточной воде мельчайших нерастворенных примесей. [c.237]
Продувка является простейшим противонакипным мероприятием, однако она целесообразна лишь в случае, когда затраты на перекачку воды и оборудование для продувки не превышают затрат на другие способы коррекции оборотной воды. Обычно стабилизация охлаждающей воды совмещает комплекс мероприятий, включающий как продувку, так и обработку воды химическими реагентами. К химическим методам обработки охлалсдающей воды относятся подкисление, рекарбонизация, фосфатирование. [c.91]
Для получения достоверных результатов пробы воды анализируют как можно скорее после отбора (в течение 1—2 ч, в крайнем случае 12 ч) или фиксируют. Пробы можно стабилизировать на несколько часов путем охлаждения их до О °С, на несколько месяцев — путем резкого охлаждения до —20 °С. Определяемые соединения фиксируют чаще всего добавлением различных консервирующих веществ. Поскольку универсального консервирующего вещества не существует, для полного анализа воды пробу обычно отбирают в несколько бутылей и консервируют ее, добавляя различные вещества. Консервирование сточных вод химическими реагентами осложняется в случае присутствия в пробе нерастворимых веществ. Оно допустимо при условии, если консервирующий реагент не препятствует определению намеченных компонентов сточной воды и если определение невозможно провести непосредственно после отбора пробы. Более подробные сведения о способах консервирования отдельных компонентов, особенностях отбора и хранения проб воды приведены в табл. 1.5. Однако ни консервирование, ни фиксация определяемых соединений путем охлаждения пробы не обеспечивают постоянного o TaiBa отобранной воды неограниченно долго. В связи с этим следует избегать длительного хранения проб. [c.44]
Эпоксидно-фурановые композиции, полученные совмещением эпоксидов (ЭД-6) с фурфуролоацетоновым мономером ФА обладают хорошими адгезионными свойствами и устойчивы к действию воды, химических реагентов, топлив и масел . [c.60]
Наиболее существенными внешними факторами являются температура, влажность, воздействие воды, химических реагентов, атмосферная коррозия. Кроме этого необходимо учитывать, особенно в случае термопластичных и эластомерных клеев, и влияние длительной нагрузки, результатом чего является ползучесть. Клеи на основе термопластичных полимеров легко деформируются при повыщенной температуре, при увеличении частоты динамического нагружения, а также при повышенном содержании растворителя или пластификатора в клее. У термореактивных клеев влияние ползучести выражено меньше. Иногда способ отверждения влияет на снижение водостойкости (например, эпоксидов, отвержденных отвердителями на основе ВРз) или повышение хрупкости. [c.96]
chem21.info
Проект по химии "Вода как реактив и среда для химических процессов" страница 6
Есть ещё несколько аномальных свойств воды:
Ни одна жидкость не поглощает газы с такой жадностью, как вода. Но она их также легко отдает. Дождь растворяет в себе все ядовитые газы атмосферы. Вода - ее мощный природный фильтр, очищающий атмосферу от всех вредных и ядовитых газов. Еще одно удивительное свойство воды проявляется при воздействии на нее магнитного поля. Вода, подвергнутая магнитной обработке, меняет растворимость солей и скорость химических реакций.
Но самое удивительное свойство воды - это свойство практически универсального растворителя. И если какие-то вещества в ней не растворяются, то и это для жизни сыграло громадную роль в эволюции: скорее всего именно гидрофобным свойствам первичных биологических мембран и обязана жизнь своим появлением и развитием в водной среде.
8. Применение воды
Роль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды.
-
В сельском хозяйстве для полива растений и питания животных
-
В химической промышленности для получения кислот, оснований, органических веществ.
-
В технике для охлаждения, в паровых двигателях.
-
В металлургии для выплавки металлов.
-
В медицине для приготовления лекарств.
-
В термоядерных реакторах для задержки нейтронов применяется тяжелая или сверхтяжелая вода (D2O, T2O соответственно; D - дейтерий, Т - тритий; это изотопы водорода).
Бурное развитие всех отраслей промышленности может повлечь за собой недостаток пресной воды. Чтобы изготовить 1 кг бумаги, требуется 100 л воды; чтобы вырастить корову требуется 100 л в сутки. Расход воды на одного городского жителя - около 40 литров в сутки. Экономисты посчитали, что все фабрики и заводы России " выпивают " за минуту целую реку Волгу. И это неудивительно. На производство одной тонны металла идет 500 тонн воды, на производство одной тонны капрона в 7-8 раз больше.
Чтобы избежать " водяного голода ", ученые предлагают опреснять воды Мирового океана. И сейчас по всей Земле строят дистилляционные установки для получения пресной воды. Есть и другие способы опреснения воды: замораживание; воздействие электротока; полупроницаемые мембраны, поры которых пропускают лишь мелкие молекулы воды, а молекулы солей задерживают и т.д.
Заключение
Вода - универсальный растворитель.
Вода является незаменимым веществом для всего живого на земле.
Вода - самое удивительное соединение на Земле.
Вода - одно из самых распространенных веществ на нашей планете.
Считают, что вода самое простое вещество на Земле. Она имеет огромное значение в эволюции как живой, так и неживой природы.
Покрывает 70% поверхности Земли и является средой обитания большого количества представителей флоры и фауны. Человеческое тело содержит около 65% воды.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое.
Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
infourok.ru